Noticias














Análisis y síntesis elaborados por el personal médico de Circle Press; agencia de periodismo científico autorizada para la cobertura del congreso ECCMID 2023, realizado de forma híbrida (virtual y presencial).La información contenida en esta sección se suministra exclusivamente al cuerpo médico con la intención de brindar información pertinente y actualizada sobre temas científicos de interés. Esta información no tiene la intención de apoyar, promocionar o recomendar indicaciones, dosificaciones o cualquier mensaje que no esté dentro de la información para prescribir aprobada de los productos de Pfizer en el país.
©Pfizer S.A.S. Todos los derechos reservados – Prohibida su reproducción total o parcial sin autorización del titular.
EM-COL-HAB-0016
Evidencia para la individualización de la dosis: dónde estamos en 2023
Farm.a Birgit Koch, Ph. D.
Farmacéutica de hospital, Farmacóloga clínica y Profesora
Erasmus MC
Países Bajos
La individualización de la dosis de antibióticos tiene como objetivo reducir la toxicidad e incrementar la eficacia terapéutica.1 Este aspecto es esencial en determinadas poblaciones de pacientes, tanto los más vulnerables como aquellos que presentan falla renal, las embarazadas o los enfermos críticos.1 Una de las estrategias interesantes para obtener la individualización de dosis es el Monitoreo Terapéutico de Medicamentos (TDM, por sus siglas en inglés), cuyo
funcionamiento se describe en detalle en el Cuadro 1.2
En 2023 se publicó una interesante revisión sistemática y metaanálisis, donde se evaluó la eficacia de los modelos de individualización de dosis (TDM o MIPD, por sus siglas en inglés; MIPD: dosificación de precisión basada en modelos) con relación al abordaje estándar. En el metanálisis se incluyeron diez ensayos aleatorizados.3 No se encontraron diferencias en la mortalidad entre ambas estrategias, aunque los modelos de individualización de dosis mostraron beneficios respecto del objetivo de alcanzar una dosis precisa de la antibioticoterapia.3

Referencias
Monitoreo terapéutico de medicamentos: un panorama a 5 años
Dra. Sophie Stocker
Escuela de Farmacia, Facultad de Salud y Medicina,
Universidad de Sídney
Sídney, Australia
El monitoreo de fármacos se realiza para identificar los factores que hacen que la respuesta sea variable entre individuos y para guiar la optimización de las dosis recomendadas.1 Sin embargo, este control presenta desafíos, ya que los costos son elevados, la obtención de la información es compleja, y se necesita de experiencia en el manejo de los software de predicción.2
En la actualidad, se está priorizando el desarrollo de dispositivos de monitoreo no invasivos, portátiles, que puedan transmitir información a distancia, y que sean operados por el paciente y más económicos. Un ejemplo en investigación y desarrollo son los biosensores, dispositivos pequeños, implantables, que utilizan sensores biológicos para detectar condiciones del medio, procesos/reacciones químicas, monitoreo continuo de las concentraciones de un fármaco y relaciones PK/PD, sin necesidad de extracción sanguínea (ver cuadro 2).3,4
En este sentido, la utilización de biosensores con aptámeros es de vanguardia. Los aptámeros son ácidos nucleicos con secuencias cortas de ADN o ARN monocatenario, seleccionados de acuerdo con su afinidad hacia una molécula diana, para lograr la mejor selectividad y especificidad. Se han utilizado rápidamente en el campo de los sensores como elementos de reconocimiento, debido a sus ventajas con respecto a los anticuerpos, como alta estabilidad, menor tamaño y alta afinidad por moléculas pequeñas. Además, son fáciles de sintetizar in vitro, simples de modificar y flexibles de diseñar. Estas características pueden contribuir a la diversificación de objetivos y mejorar la detección mediante uniones más eficientes.5

Referencias
Optimización de dosis en los programas de administración de antibióticos
Dr. Thomas Tängdén, Ph. D.
Profesor Asociado de Enfermedades Infecciosas de la Universidad de Upsala
Suecia
En el hospital se cuenta con tres niveles de dosis óptimas de antibióticos: estándar, grupal e individual.
La dosis estándar se deriva de estudios, en su mayoría en animales o también en grupos heterogéneos de personas, que se realizan utilizando los valores otorgados por EUCAST (Comité Europeo para el Testeo de Susceptibilidad Antimicrobiana).
La dosis grupal tiene en cuenta factores como embarazo, falla renal, peso corporal, edad, etc. Esta dosis es determinada principalmente por la opinión de expertos, ya que no hay suficiente evidencia clínica, lo que genera mucha variabilidad. En estos casos, resultan útiles los modelos de predicción de PK/PD (índices farmacocinéticos y farmacodinámicos).
Los enfermos críticos son un grupo a tener en cuenta, ya que las dosis subóptimas no van a generar buen resultado. En un metaanálisis se evidenció que la infusión continua es una buena estrategia para los betalactámicos. Al igual que con el grupo estándar, las limitaciones son la falta de evidencia clínica.1
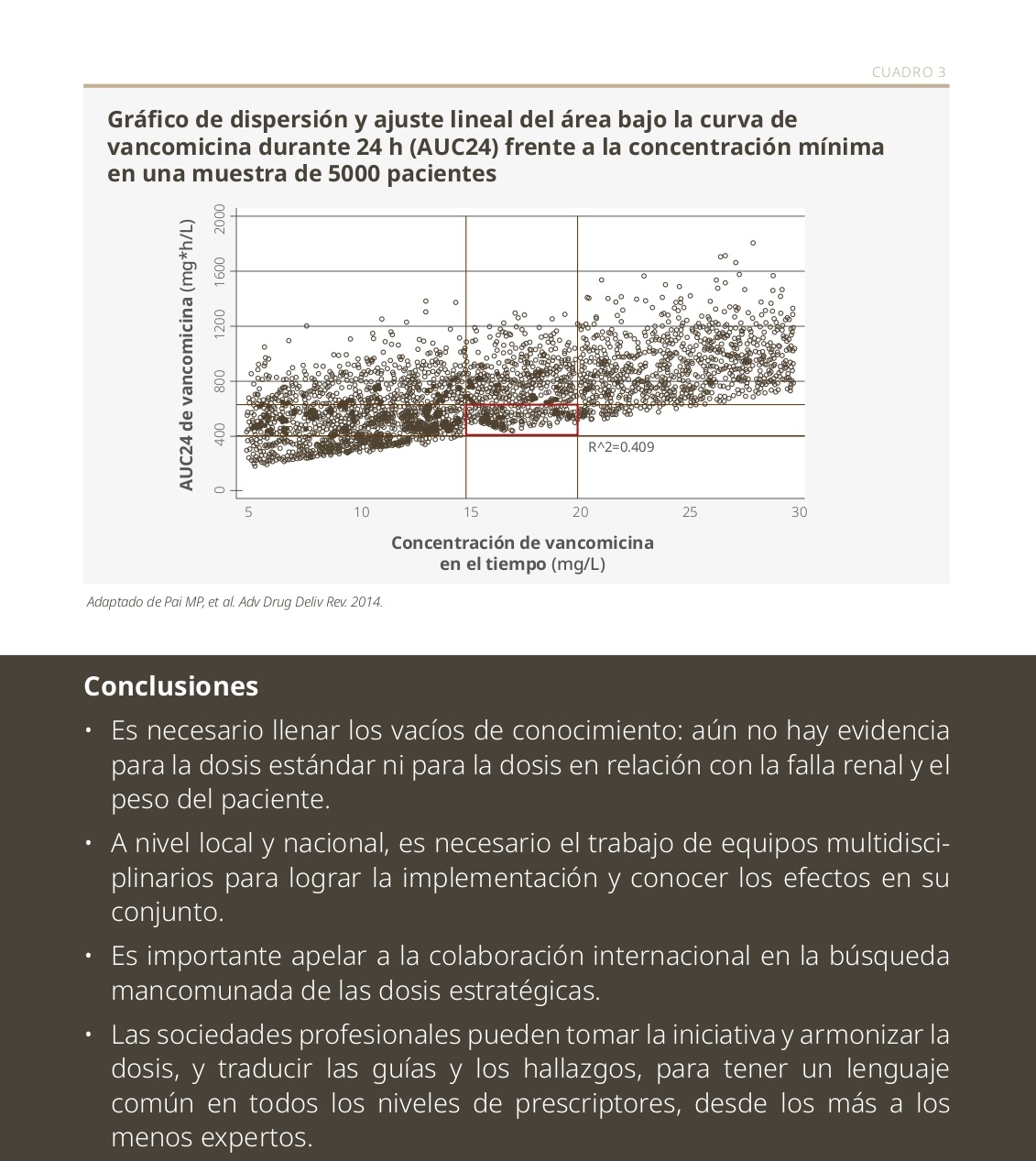
La dosis individualizada deriva de la utilización del Monitoreo Terapéutico de Medicamentos (TDM, por sus siglas en inglés), lo cual reduce el riesgo de toxicidad y de resistencia bacteriana. En estos casos se utilizan datos del paciente, de estudios in vitro y clínicos de PK.2 El beneficio de esta estrategia se observa especialmente en el caso de la vancomicina, donde se requieren dosis individuales precisas para evitar la toxicidad (ver Cuadro 3).3 Con los betalactámicos o la ciprofloxacina, es más difícil el estudio, porque la PK tiene una variabilidad significativa y resulta necesario explorar otras alternativas.4
La diferencia se logra en los pacientes que tienen un riesgo de dosis baja con dosis estándar, como los enfermos críticos, y también en los pacientes infectados por gram negativos.
La implementación de la dosis individualizada (TDM) depende del acceso a la medición del fármaco. Si esto es posible, lo recomendable es pedir las concentraciones total y libre.
Referencias
Lipman J, et al. A protocol for a phase 3 multicentre randomised controlled trial of continuous versus intermittent β-lactam antibiotic infusion in critically ill patients with sepsis: BLING III. Crit Care Resus. 2019 Mar;21(1):63-68. PMID: 30857514.
Tängdén T, et al. The role of infection models and PK/PD modelling for optimising care of critically ill patients with severe infections. Intensive Care Med. 2017 Jul;43(7):1021-1032. doi: 10.1007/s00134-017-4780-6. Epub 2017 Apr 13. PMID: 28409203.
Pai MP, et al. Innovative approaches to optimizing the delivery of vancomycin in 3 individual patients. Adv. Drug Deliv. Rev. 2014.http://dx.doi.org/10.1016/j.addr.2014.05.016.
Ewoldt TMJ, et al. Model-informed precision dosing of beta-lactam antibiotics and ciprofloxacin in critically ill patients: a multicentre randomised clinical trial. Intensive Care Med. 2022 Dec;48(12):1760-1771. doi: 10.1007/s00134-022-06921-9. Epub 2022 Nov 9. PMID: 36350354; PMCID: PMC9645317.
Tratamientos antimicrobianos cortos para la neutropenia febril
Dra. Carlota Gudiol
Departamento de Enfermedades Infecciosas
Hospital Universitario de Bellvitge
Barcelona, España
El tratamiento de la neutropenia febril con antibioticoterapia empírica puede tener el escenario de una infección documentada clínica o microbiológicamente, o no tener una causa documentada (fiebre de origen desconocido, FOD). En este contexto, la continuación del tratamiento antibiótico empírico inicial por períodos prolongados ofrece varias desventajas:
efectos adversos (toxicidad por fármacos, mayor alteración del microbioma que conlleva un aumento del riesgo de enfermedad de injerto contra huésped); superinfecciones (C. difficile, bacterias resistentes, hongos filamentosos); emergencia y diseminación de resistencia a antibióticos; y aumento de costos,1 además de mayores períodos de internación y morbimortalidad. Sin embargo, pese a que sólo el 30% de los pacientes con neutropenia febril tienen una infección documentada, el uso de tratamientos prolongados sigue siendo frecuente.2
Las guías clínicas recomiendan la suspensión de antibióticos en pacientes con fiebre sin causa documentada, estabilidad clínica durante 72-96 horas y apirexia durante 48 horas, independientemente del recuento absoluto de neutrófilos. En los pacientes con infección documentada, se recomienda continuar por un mínimo de 7 días o más, hasta que la infección
esté clínicamente resuelta.3 La evidencia actual muestra que no hay aumento de la mortalidad en pacientes con FOD que descontinúan antibióticos, en comparación con quienes continúan bajo tratamiento hasta la resolución de la neutropenia, aunque la certidumbre de este dato es baja (ver Cuadro 4).4
En los pacientes con infección documentada (incluyendo bacteriemia), la evidencia también apoya el uso de cursos cortos de antibióticos,5 pero con monitoreo estrecho del paciente luego de la suspensión, y el reinicio ante cambios clínicos o la reaparición de la fiebre. Es necesario contar con más ensayos clínicos bien diseñados que aporten información con mejor nivel de evidencia para el manejo óptimo de la duración del tratamiento antibiótico en la neutropenia febril.
Referencias
Implementación de programas ambulatorios en adultos y niños con neutropenia febril
Prof.a Dra. Gabrielle Haeusler
Murdoch’s Children Research Institute
Melbourne, Australia
En el estudio PICNICC, realizado en pacientes pediátricos con neutropenia febril, el 55% de los episodios tuvieron causa no identificada, el 21.6% se produjeron por infección no bacteriémica definida microbiológicamente, el 12.9% presentaron bacteriemia y, el 9.3%, infección definida por criterios clínicos.1 La necesidad de hospitalización afecta negativamente la calidad de vida de los pacientes. Por esta razón, en ellos y su familia, existe una fuerte preferencia por internaciones breves, siempre y cuando esto sea seguro.2
El desarrollo de una herramienta de predicción clínica del riesgo de infección permite estratificar el riesgo de los pacientes y tratarlos en forma ambulatoria de manera segura. La escala AUS consiste en evaluar la presencia (1 punto) o ausencia (0 puntos) de: 1) quimioterapia previa de mayor intensidad a la de mantenimiento por leucemia linfoide aguda (LLA), 2) recuento total de glóbulos blancos <0.3 x 109/L, y 3) recuento de plaquetas <50 x 109/L. Los puntajes finales posibles son 0 (muy bajo riesgo), 1 (bajo riesgo), 2 (riesgo moderado) y 3 (alto riesgo). El uso de esta regla, junto con la exclusión de pacientes por criterios de seguridad adicionales, permite identificar individuos que pueden tratarse de manera ambulatoria entre 4 y 48 horas después del episodio.
Los pacientes clínicamente estables y que cumplen todos los criterios de seguridad pueden ser transferidos a un programa de “neutropenia febril de bajo riesgo” después de un mínimo de 4 horas de observación (puntaje 0, grupo de muy bajo riesgo) o dentro de las 24 horas (puntaje 1, bajo riesgo) (ver cuadro 5).3 Cuando el puntaje es 2 (riesgo moderado), puede considerarse la transferencia a un programa de “neutropenia febril de bajo riesgo” después de un mínimo de 24 horas de observación. En los pacientes de alto riesgo (puntaje 3), es necesario observar la estabilidad
clínica durante un mínimo de 36-48 horas de internación antes de considerar la posibilidad de transferencia. Este protocolo permitió la realización de tratamientos ambulatorios precoces en el 22% de los pacientes. La reducción de la mediana de hospitalización fue de 4.0 a 1.5 días (p=0.05).2 Su utilidad fue revalidada en 13 centros del Reino Unido, donde el 46% de los pacientes fue transferido a su hogar con antibióticos orales dentro de las 24 horas; la tasa de rehospitalización fue del 14%.2

Referencias











